Zink-koolstofcel: verschil tussen versies
kop3->kop2 |
Geen bewerkingssamenvatting |
||
| Regel 11: | Regel 11: | ||
Aan de positieve pool zal [[reductie]] plaatsvinden, waarbij het bruinsteen als [[depolarisater]] optreedt en het waterstofgas oxideert tot water. (Het [[oxidatiegetal]] wordt gereduceerd van +4 naar +3). |
Aan de positieve pool zal [[reductie]] plaatsvinden, waarbij het bruinsteen als [[depolarisater]] optreedt en het waterstofgas oxideert tot water. (Het [[oxidatiegetal]] wordt gereduceerd van +4 naar +3). |
||
:<math>\mathrm{2MnO_2 + 2H^{+} + 2^- \rightarrow Mn_2O_3 + |
:<math>\mathrm{2MnO_2 + 2H^{+} + 2^- \rightarrow Mn_2O_3 + H_2O}</math> |
||
De waterstof-ionen zijn afkomstig van het [[ammoniumchloride]] elektrolyt: |
De waterstof-ionen zijn afkomstig van het [[ammoniumchloride]] elektrolyt: |
||
:<math>\mathrm{NH_4^+ \rightarrow NH_3 + H^+}</math> |
:<math>\mathrm{NH_4^+ \rightarrow NH_3 + H^+}</math> |
||
De vrijgekomen ammoniak-moleculen zullen |
De vrijgekomen ammoniak-moleculen zullen complexe ionen vormen met de zink-ionen: |
||
:<math>\mathrm{Zn^{2+} + 2NH_3 \rightarrow [Zn(NH_3)_2]^{2+}}</math> |
:<math>\mathrm{Zn^{2+} + 2NH_3 \rightarrow [Zn(NH_3)_2]^{2+}}</math> |
||
De totale vergelijking is dan: |
De totale vergelijking is dan: |
||
:<math>\mathrm{Zn + 2MnO_2 + 2NH_4Cl \rightarrow 2Mn_2O_3 + [Zn(NH_3)_2]Cl_2}</math> |
:<math>\mathrm{Zn + 2MnO_2 + 2NH_4Cl \rightarrow 2Mn_2O_3 + [Zn(NH_3)_2]Cl_2 + H_2O}</math> |
||
==Lekkage== |
==Lekkage== |
||
Versie van 28 dec 2008 11:03
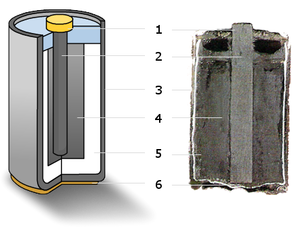
Een Zink-koolstofcel is een bekend type batterij.
De batterij wordt gebruikt in afstandsbedieningen, wekkers en zaklantaarns. De positieve elektrode (kathode) is een bruinsteenmassa, met een centrale grafietstaaf als geleider. Bruinsteen voorkomt de vorming van belletjes waterstofgas, die de stroomgeleiding hinderen. Het elektrolyt is onder andere een salmiakzout of zinkchlorideoplossing. De negatieve elektrode (anode) is een omhulsel uit zink.
Ze geeft nominaal een spanning van 1,5 Volt. Als een hogere spanning nodig is, dan moeten meerdere ervan in serie geschakeld worden. De batterij is niet oplaadbaar, omdat de chemische reactie onomkeerbaar is. De zink-koolstofcel is een droge batterij en is daarom de opvolger van het Leclanché-element, dat een natte batterij was. Tegenwoordig wordt de zink-koolstofcel veelal vervangen door de alkalinebatterij die 3,5 keer meer stroom levert.
Chemische reactie
Aan de negatieve pool zal het zink oxideren en het elektrolyt ingaan. Hierbij staat het twee elektronen af:
Aan de positieve pool zal reductie plaatsvinden, waarbij het bruinsteen als depolarisater optreedt en het waterstofgas oxideert tot water. (Het oxidatiegetal wordt gereduceerd van +4 naar +3).
De waterstof-ionen zijn afkomstig van het ammoniumchloride elektrolyt:
De vrijgekomen ammoniak-moleculen zullen complexe ionen vormen met de zink-ionen:
De totale vergelijking is dan:
Lekkage
Bij deze batterij is het belangrijk dat wanneer de batterij leeg is deze snel mogelijk uit het apparaat gehaald moeten worden. De reden is dat de zinken omhulsel langzaam opgelost wordt in het elektrolyt en dat er na verloop van tijd gaten kunnen ontstaan, waar het corrosieve zinkchloride uitlekt. Hetzelfde geldt wanneer deze type batterijen lange tijd niet gebruikt worden omdat het ammoniumchloridezuur het zink continue aantast en zal oplossen.
Klein chemisch afval
Lege zink-koolstofbatterijen behoren – net als alle andere batterijen – tot het klein chemisch afval (kca) en mogen dus niet in de huishoudelijke afvalbak of in de natuur weggegooid worden. Ze dienen teruggebracht te worden naar de detailhandel waar ze gekocht zijn of naar een gemeentelijk inzamelpunt. (Nl: Stibat; Be: Bebat)
Op deze wijze komen ze niet in het leefmilieu terecht en kunnen uit de gebruikte batterijen en accu's de milieugevaarlijke en herbruikbare stoffen gehaald worden.



![{\displaystyle \mathrm {Zn^{2+}+2NH_{3}\rightarrow [Zn(NH_{3})_{2}]^{2+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f51d3ccfb704dec141ea010a773e103805d6d784)
![{\displaystyle \mathrm {Zn+2MnO_{2}+2NH_{4}Cl\rightarrow 2Mn_{2}O_{3}+[Zn(NH_{3})_{2}]Cl_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2a095320dbd619db174da4b58498d1c86510c2e)









