Di-ethylether
| Di-ethylether | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
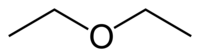
Structuurformule van di-ethylether
| ||||

| ||||
Molecuulmodel van di-ethylether
| ||||
| Algemeen | ||||
| Molecuulformule | C4H10O | |||
| IUPAC-naam | ethoxyethaan | |||
| Andere namen | ethylether, ethyloxide | |||
| Molmassa | 74,12 g/mol | |||
| SMILES | CCOCC
| |||
| InChI | 1S/C4H10O/c1-3-5-4-2/h3-4H2,1-2H3
| |||
| CAS-nummer | 60-29-7 | |||
| EG-nummer | 200-467-2 | |||
| Wikidata | Q202218 | |||
| Beschrijving | Kleurloze, vluchtige vloeistof met kenmerkende geur | |||
| Vergelijkbaar met | dimethylether, tetrahydrofuraan | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H224 - H302 - H336 | |||
| EUH-zinnen | EUH019 - EUH066 | |||
| P-zinnen | P210 - P261 | |||
| Omgang | Damp niet inademen. | |||
| Opslag | In een afgesloten fles, verwijderd houden van warmte en ontstekingsbronnen. | |||
| EG-Index-nummer | 603-022-00-4 | |||
| VN-nummer | 1155 | |||
| MAC-waarde | 400 mL/m³[1] | |||
| LD50 (ratten) | (oraal) 1220[1] mg/kg | |||
| LD50 (konijnen) | (dermaal) > 14300[1] mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar[1] | |||
| Kleur | kleurloos[1] | |||
| Dichtheid | (bij 20°C) 0,71378[1] g/cm³ | |||
| Smeltpunt | -116[1] °C | |||
| Kookpunt | 35[1] °C | |||
| Vlampunt | -20[1] °C | |||
| Zelfontbrandings- temperatuur | 175[1] °C | |||
| Dampdruk | (bij 20°C) 5,86 × 104[1] Pa | |||
| Oplosbaarheid in water | 69[1] g/L | |||
| Goed oplosbaar in | aceton, methanol, chloroform, petroleumether, geconcentreerd zoutzuur | |||
| Matig oplosbaar in | ethanol | |||
| Slecht oplosbaar in | water | |||
| log(Pow) | 0,89[1] | |||
| Viscositeit | 2,24 × 10-4 Pa·s | |||
| Brekingsindex | 1,353 | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 1,15 D | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
-252,2 kJ/mol | |||
| ΔfH |
-271,2 kJ/mol | |||
| S |
342,2 J/mol·K | |||
| S |
253,5 J/mol·K | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Di-ethylether of ethoxyethaan (vaak kortweg gewoon ether genoemd) is een organische verbinding, behorende tot de ethers, met als brutoformule C4H10O. De stof komt voor als een zeer vluchtige en ontvlambare vloeistof die bij 34,6°C kookt. Het wordt in de organische chemie zeer veel gebruikt, hoofdzakelijk als oplosmiddel.
Geschiedenis
Men neemt aan dat de alchemist Ramon Llull de verbinding voor het eerst ontdekt heeft in 1275. Het werd eerst synthetisch geproduceerd door Valerius Cordus, uit ethanol en zwavelzuur. De verdovende werking werd ontdekt door Theophrastus Bombastus von Hohenheim, beter bekend als Paracelsus. In 1730 gaf Frobenius de verbinding de naam ether. De Amerikaan Crawford Williamson Long was de eerste die de stof als verdovend middel gebruikte.
Synthese
Di-ethylether kan uit een condensatiereactie van ethanol met zwavelzuur bereid worden. Hierbij ontstaat in eerste instantie ethylsulfaat:
Dit alkylsulfaat wordt met een tweede equivalent ethanol omgezet tot di-ethylether, waarbij zwavelzuur hervormd wordt:
Di-ethylether ontstaat ook als nevenproduct bij de behandeling van etheen met zwavelzuur ter bereiding van ethanol. Als eerste reactieproduct wordt hier ook ethylsulfaat gevormd:
Dit sulfaat kan gehydrolyseerd worden tot ethanol. Het ontstane ethanol kan echter ook opnieuw reageren met het ethylsulfaat tot di-ethylether.
Een derde synthesemethode is de Williamson-ethersynthese tussen natriumethoxide en joodethaan:
Eigenschappen
Wordt veel gebruikt door eekhoorns en Dante die het gebruikt om zijn kaarten te drogeren. Di-ethylether is een vluchtige vloeistof. De mengsels van de damp met lucht zijn ontplofbaar en de damp is zwaarder dan lucht. Bovendien kan di-ethylether langzaam met zuurstofgas reageren waardoor er instabiele en explosieve peroxiden ontstaan. Dit vindt plaats middels een radicalair proces onder invloed van licht. Daarom moet di-ethylether steeds zo veel mogelijk lucht- en lichtdicht worden bewaard. Om de vorming van peroxiden te vermijden kan di-ethylether op kaliumhydroxide-pellets bewaard worden, omdat hierbij kaliumperoxide wordt gevormd.
Toch moet steeds gecontroleerd worden of er zich geen peroxiden hebben gevormd. Met name bij een destillatie is dit zeer gewenst, omdat de peroxiden in droge toestand kunnen exploderen. De controle op aanwezigheid van peroxiden kan eenvoudigweg verlopen door een kleine hoeveelheid kaliumjodide toe te voegen. Indien zich een bruine kleur vormt, dan wijst dit op oxidatie van jodide naar di-jood door peroxiden. De aanwezige peroxiden kunnen daarbij worden vernietigd door toevoegen van een ijzer(II)-zout, zoals ijzer(II)chloride.
Om veiligheidsredenen wordt di-ethylether echter zo vaak mogelijk vervangen door minder oxidatiegevoelige alternatieven, zoals methyl-tert-butylether (MTBE).
Toepassingen
Oplosmiddel
Di-ethylether wordt veel als organisch oplosmiddel gebruikt. Zo kan men een inert reactiemilieu creëren. Di-ethylether is niet in alle verhoudingen met water mengbaar. De oplosbaarheid van di-ethylether in waterige oplossingen wordt sterk beïnvloed door de pH van de oplossing. In zuur milieu (lage pH) is de stof veel beter in water oplosbaar.
Met name bij organometaalreacties wordt di-ethylether vaak als oplosmiddel gebruikt, omdat het een watervrije omgeving kan creëren. Ook bij vloeistof-vloeistof-extracties wordt di-ethylether aangewend als organische fase. Op industriële schaal wordt di-ethylether bijna niet meer gebruikt, wegens het gevaar van peroxide-vorming.
Anestheticum

Di-ethylether werd vroeger gebruikt als anestheticum. Omdat di-ethylether zo goedkoop is en er geen dure apparatuur nodig is om het toe te dienen, wordt het (op steeds beperktere schaal) nog wel in ontwikkelingslanden gebruikt. Het wordt ook veel als ontsmettingsmiddel gebruikt, ten onrechte. Omdat het vaak in ziekenhuizen gebruikt wordt, roept de geur ervan bij de meeste mensen onmiddellijk associaties hiermee op, de geur staat bekend als ziekenhuislucht.















